Kegiatan Belajar ini merupakan tindak lanjut persamaan gelombang oleh Erwin Schrodinger, yang akan memperjelas kemungkinan ditemukannya elektron melalui bilangan-bilangan kuantum. Daerah paling mungkin ditemukannya elektron disebut orbital, sehingga bilangan-bilangan akan memperjelas posisi elektron dalam atom.
Ada empat bilangan kuantum yang akan kita kenal, yaitu bilangan kuantum utama (n), bilangan kuantum Azimut (I), bilangan kuantum magnetic (m) dan bilangan kuantum spin (s).
A. Pengertian Bilangan Kuantum
Marilah kita pelajari satu persatu pengertian bilangan-bilangan kuantum.
1.Bilangan Kuantum Utama (n)
Lambang dari bilangan kuantum utama adalah “n” (en kecil). Bilangan kuantum utama menyatakan kulit tempat ditemukannya elektron yang dinyatakan dalam bilangan bulat positif. Nilai bilangan itu di mulai dari 1, 2, 3 dampai ke-n.
Masih ingatkah Anda dengan jenis-jenis kulit atom berdasarkan konfigurasi elektron yang telah dibahas di kelas X (Modul Kim. X.03). Jenis-jenis kulit atom berdasarkan konfigurasi elektron tersebut adalah K, L, M dan N.
Cobalah Anda perhatikan Tabel 1.
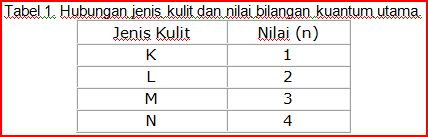
Tabel ini dapat dibuktikan bahwa untuk kulit K memiliki nilai bilangan kuantum utama (n) = 1, kulit L memiliki nilai bilangan kuantum utama (n) = 2 dan seterusnya.
Semakin dekat letak kulit atom dengan inti maka nilai bilangan kuantum utama semakin kecil (mendekati 1). Sehingga bilangan kuantum utama dapat Anda gunakan untuk menentukan ukuran orbit (jari-jari) berdasarkan jarak orbit elektron dengan inti atom.
Kegunaan lainnya, Anda dapat mengetahui besarnya energi potensial elektron. Semakin dekat jarak orbit dengan inti atom maka kekuatan ikatan elektron dengan inti atom semakin besar, sehingga energi potensial elektron tersebut semakin besar.
Setelah Anda mempelajari uraian tadi, sudahkan anda memahami arti dan fungsi bilangan kuantum utama?
Seandainya Anda paham, pelajari kembali penjelasan bilangan kuantum utama tersebut. Kalau sudah marilah kita lanjutkan ke jenis bilangan kuantum berikutnya.
2. Bilangan Kuantum Azimut (l)
Bilangan kuantum azimut menyatakan sub kulit tempat elektron berada dan bentuk orbital, serta menentukan besarnya momentum sudut elektron terhadap inti.
Banyaknya subkulit tempat elektron berada tergantung pada nilai bilangan kuantum utama (n). Nilai bilangan kuantum azimut dari 0 sampai dengan (n – 1). Bila n = 1, maka hanya ada satu subkulit yaitu l = 0. Sedangkan n = 2, maka ada dua subkulit yaitu l = 0 dan l = 1.
Seandainya dibuat dalam tabel maka akan tampak sebagai berikut :
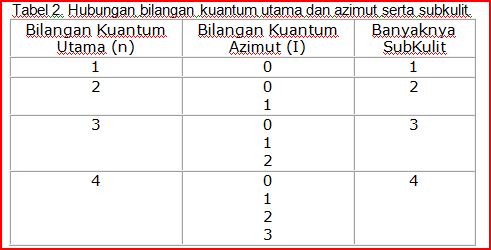
Kesimpulan yang dapat diambil dari tabel adalah :
Banyaknya subkulit sama dengan nilai bilangan kuantum utama.
Subkulit ditandai dengan huruf yang didasarkan pada garis-garis spektrum yang tampak pada spektroskopi secara berurutan, seperti tabel 3.

Janganlah Anda lupakan subkulit ini dengan bilangan kuantumnya!
Tanda subkulit ini akan digunakan pula dalam konfigurasi elektron dan sistem periodik pada kegiatan belajar 3 dan 4 dalam modul ini.
Masih ingatkah Anda bahwa setiap kulit terdiri dari beberapa subkulit. Hal ini memungkinkan untuk kulit yang berbeda akan memiliki jenis subkulit yang sama.
Perhatikan contoh tabel 4!
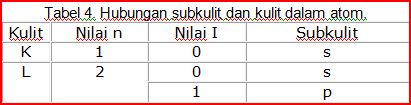
Kulit K dan L sama-sama memiliki subkulit s.
Bagaimana dengan kulit berikutnya?
Silahkan Anda lanjutkan untuk kulit M dan N!
Jawaban Anda akan benar jika seperti berikut :
Kulit M, maka nilai n=3 dan l=0, 1, dan 2 sehingga subkulitnya s, p, dan d.
Kulit N, maka nilai n=4 dan l=0, 1, 2, dan 3 sehingga subkulitnya s, p, d, dan f.
Dari latihan yang telah Anda kerjakan, Anda dapat melihat bahwa jenis subkulit yang sama dapat dimiliki oleh jenis kulit yang berbeda. Untuk membedakan jenis subkulit dari suatu jenis kulit ditambahkan bilangan kuantum utama. Dengan demikian, tabel sebelumnya dapat dilengkapi menjadi tabel 5.
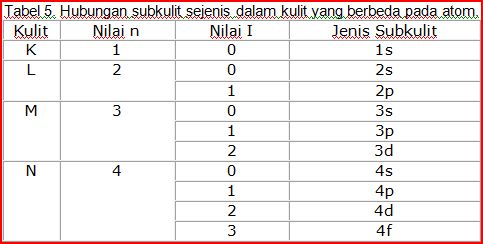
Sebagaimana Anda telah pelajari teori atom modern, bahwa setiap subkulit dari orbital, maka satu orbital dinyatakan dalam satu buah kotak. Masing-masing orbital mempunyai bentuk yang khas. Bentuk orbital akan dipelajari setelah kita selesai mempelajari ke empat bilangan kuantum.
Marilah kita lanjutkan jenis bilangan kuantum selanjutnya!
3. Bilangan Kuantum Magnetik (m)
Bilangan kuantum magnetik menyatakan orbital tempat ditemukannya elektron pada subkulit tertentu dan arah momentum sudut elektron terhadap inti. Sehingga nilai bilangan kuantum magnetik berhubungan dengan bilangan kuantum azimut. Nilai bilangan kuantum magnetik antara – l sampai + l.
Hubungan antara bilangan kuantum azimut dengan bilangan kuantum magnetik dapat Anda perhatikan pada tabel 6.

Dapatkah anda memahami tabel 1.6 ?
Jika bilangan kuantum azimut (l) = 0, maka atom tersebut memiliki orbital s dengan kotak sebanyak 1 dan bilangan kuantum magnetik 0. sedangkan bilangan kuantum azimut 1, akan memiliki orbital p dengan kotak yang saling menempel sebanyak 3 dan bilangan kuantum magnetik masing-masing kotak secara urut dari kiri ke kanan –1, 0 dan +1. Demikian masing-masing halnya untuk bilangan kuantum azimut selanjutnya.
4. Bilangan Kuantum Spin (s)
Lambang bilangan kuantum spin adalah s yang menyatakan arah rotasi elektron pada porosnya. Ada dua kemungkinan arah rotasi yaitu searah jarum jam atau berlawanan arah jarum jam. Hal ini seperti berputarnya gasing atau mata uang logam. Pernahkan Anda bermain gasing? Apakah Anda memperhatikan arah berputarnya gasing pada porosnya? Jika belum pernah bermain gasing, cobalah dengan cara lain seperti berikut ini! Letakan uang logam tegak dengan lantai yang dipegang oleh ibu jari dan jari telunjuk.
Perhatikan gambar!
Setelah koin berdiri tegak, bengkokkan jari telunjuk Anda.
Apa yang terjadi?
Bagaimana seandainya ibu jari yang di bengkokkan?
Jika Anda melakukan dengan benar, maka pada saat ibu jari telunjuk yang dibengkokkan maka uang logam akan berputar searah jarum jam, sedangkan untuk ibu jari yang dibengkokkan maka uang logam akan berputar berlawanan arah jarum jam.
Begitulah elektron yang berotasi, bila searah jarum jam maka memiliki nilai s=+½ dan dalam orbital dituliskan dengan tanda panah ke atas. Sebaliknya untuk elektron yang berotasi berlawanan arah jarum jam maka memiliki nilai s = -½ dan dalam orbital dituliskan dengan tanda panah ke bawah.
Dari uraian arah rotasi maka kiata dapat mengetahui bahwa dalam satu orbital atau kotak maksimum memiliki 2 elektron.
Marilah kita gabungkan ke empat uraian tentang bilangan kuantum yang telah dipelajari.
Perhatikanlah tabel 7.
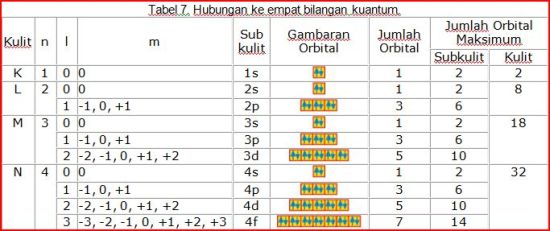
Apa yang dapat Anda simpulkan dari tabel 7 ?
Bila kulit atom sama (bilangan kuantum utama sama), subkulit (bilangan kuantum azimut) dan orbital (bilangan kuantum magnetik) serta arah (bilangan kuantum spin) dapat berbeda.
Contohnya:
kulit ke 2 dapat memiliki bilangan kuantum azimut 0 atau 1 dan bilangan kuantum magnetiknya bisa –1, 0 atau +1 sesuai dengan posisi dalam kotak serta memiliki bilangan kuantum spin yang dapat berbeda sesuai arah panahnya.
Tidak ada komentar:
Posting Komentar